
云南白药核药研发再迈一步,双中心临床试验同步完成
发布时间:2025/5/16 8:57:00核药正在成为业内炙手可热的新赛道。据中信证券研报,全球靶向放射性核素疗法(TRT)治疗药物市场有望在2030年前突破300亿美元。国外市场,核药巨头诺华凭借两款产品Lutathera和Pluvicto 年揽金逾20亿美元。2024年,Pluvicto销售额达 13.92 亿美元,同比增长 42%,成为首个年销售额突破10亿美元的核药。国内市场,远大医药2024年核药抗肿瘤板块表现亮眼,核心产品钇[90Y]微球注射液实现收入近5亿港元,同比增长超176%,推动公司全年营收达116.4亿港元。
云南白药自2022年切入核药赛道后,研发进展显著。根据国家药品监督管理局药品审评中心(CDE)官网显示,云南白药集团股份有限公司的全资子公司云核医药(天津)有限公司自主研发的化药1类放射性诊断药物“INR101注射液”及化药1类放射性治疗新药“INR102注射液”获得临床试验默示许可。
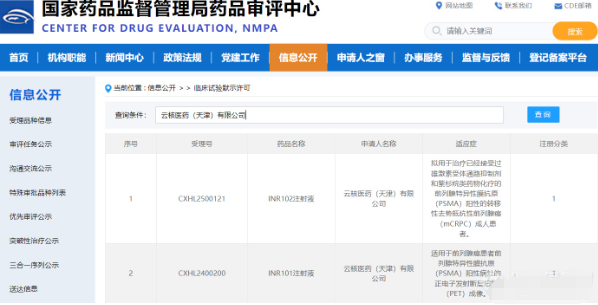
5月13日,云南白药发布公告宣布,INR101注射液Ⅲ期临床试验在武汉市中心医院和泰州市人民医院同步完成首例受试者入组。此次INR101注射液Ⅲ期临床试验由复旦大学附属中山医院牵头,联合全国30多家顶尖 GCP 机构共同开展,旨在进一步验证其在前列腺癌患者中的诊断效能及安全性,为上市提供关键数据支持。
INR101注射液适用于前列腺癌患者靶向前列腺特异性膜抗原(PSMA)阳性病灶的PET(正电子发射断层扫描)成像,通过高灵敏度显像技术,该药物可精准定位肿瘤病灶,为临床诊疗提供可视化、定量化的决策依据。未来,云南白药集团将以INR101注射液Ⅲ期临床试验为契机,加速推进核药管线的研发与商业化进程,深化与医疗机构、科研院所的合作,打造“诊疗一体化”创新生态,为患者提供更高效的精准医疗解决方案。
云核医药是云南白药2023年7月成立的全资子公司,2024年底,云南白药集团中央研究院天津中心建成并投入使用,后续将推动多款核药产品进入临床(试验)阶段。